Rezky P
02 Desember 2023 04:37
Iklan
Rezky P
02 Desember 2023 04:37
Pertanyaan
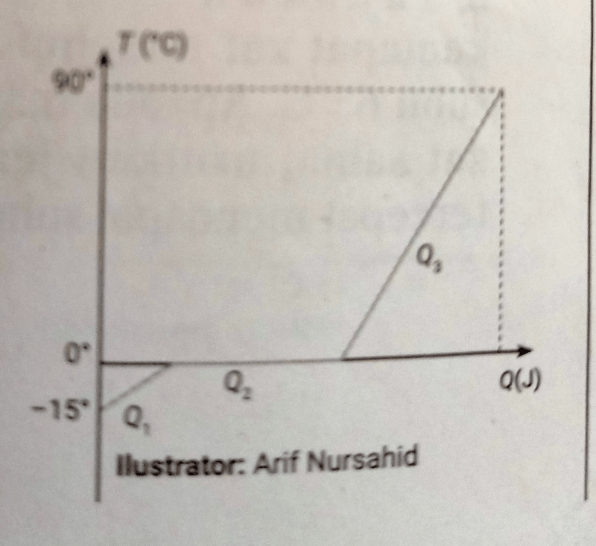
5. Pemanasan 3 kg es ditunjukkan pada grafik berikut Kalor jenis es 2.100 J/kg°C. Jika kalor lebur es 336.000 J/kg, tentukan kalor yang dibutuhkan dari proses Q1(-15°C) menuju Q3 (90°C )adalah ... a. 2.236,5 kJ b. 2,345,2 kJ a. 2.456,5 kJ b. 2,543,2 kJ
5. Pemanasan 3 kg es ditunjukkan pada grafik berikut
Kalor jenis es 2.100 J/kg°C.
Jika kalor lebur es 336.000 J/kg,
tentukan kalor yang dibutuhkan dari proses Q1(-15°C) menuju Q3 (90°C )adalah ...
a. 2.236,5 kJ
b. 2,345,2 kJ
a. 2.456,5 kJ
b. 2,543,2 kJ
24
2
Iklan
Sumber W

Community
07 Desember 2023 04:39
<p>Jawaban yang benar adalah A. 2.236,5 kJ</p><p> </p><p> </p><p>Pembahasan :</p><p>Rumus kalor :</p><p>Q = m x C x Δt</p><p>Q = Kalor (J)</p><p>m = Massa (kg)</p><p>C = Kalor jenis (J/Kg°C)</p><p>Δt = Perubahan suhu (°C)</p><p> </p><p>Q = Q1 + Q2 + Q3</p><p> = (m x C<sub>es</sub> x Δt) + (m x L) + (m x C<sub>air</sub> x Δt)</p><p> = (3 x 2100 x (0 - (-15°))) + (3 x 336.000) + (3 x 4200 x (90° - 0°))</p><p> = (3 x 2100 x 15) + (3 x 336.000) + (3 x 4200 x 90°)</p><p> = 94.500 + 1.008.000 + 1.134.000)</p><p> = 2.236.500 Joule</p><p> = 2.236,5 kJ</p><p> </p>
Jawaban yang benar adalah A. 2.236,5 kJ
Pembahasan :
Rumus kalor :
Q = m x C x Δt
Q = Kalor (J)
m = Massa (kg)
C = Kalor jenis (J/Kg°C)
Δt = Perubahan suhu (°C)
Q = Q1 + Q2 + Q3
= (m x Ces x Δt) + (m x L) + (m x Cair x Δt)
= (3 x 2100 x (0 - (-15°))) + (3 x 336.000) + (3 x 4200 x (90° - 0°))
= (3 x 2100 x 15) + (3 x 336.000) + (3 x 4200 x 90°)
= 94.500 + 1.008.000 + 1.134.000)
= 2.236.500 Joule
= 2.236,5 kJ
· 3.5 (6)
Iklan
Dela A

Community
07 Desember 2023 05:13
Jawaban yang tepat untuk soal tersebut adalah = 2.236,5 kJ Perlu diingat bahwa Rumus kalor: Q = m x C x At Dimana, Q = Kalor (J) m = Massa (kg) C = Kalor jenis (J/Kg°C) At = Perubahan suhu (°C) Dari rumus tersebut kita bisa menentukan jumlah kalor yang dibutuhkan dari proses Q1(–15°C) menuju ke Q3(90°C), yaitu Q = Q1 Q2 + Q3 = (m x C es x At) + (m x L) + (m x C air X At) = (3 x 2100 x (0- (-15°))) + (3 x 336.000) + (3 x 4200 x (90° -0°)) = (3 x 2100 x 15°) + (3 x 336.000) + (3 x 4200 x 90°) = 94.500 + 1.008.000 + 1.134.000 = 2.236.500 Joule = 2.236,5 kJ
· 3.0 (1)
Dela A

Community
07 Desember 2023 05:14
Opsi A. 2.236,5 kJ
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!
Roboguru Plus
Dapatkan pembahasan soal ga pake lama, langsung dari Tutor!


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



