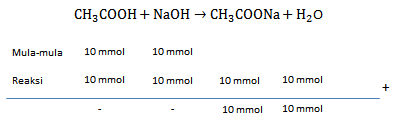Iklan
Iklan
Pertanyaan
Seorang siswa melakukan percobaan hidrolisis garam dengan mencampurkan larutan CH 3 COOH dan NaOH dengan data percobaan sebagai berikut: Jika ( K a = 1 0 − 5 ; lo g 5 = 0 , 70 ; lo g 7 = 0 , 84 ) tentukan pH pada percobaan 2.
Seorang siswa melakukan percobaan hidrolisis garam dengan mencampurkan larutan dan dengan data percobaan sebagai berikut:
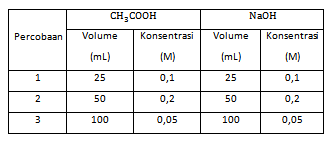
Jika tentukan pH pada percobaan 2.
Iklan
JS
J. Siregar
Master Teacher
Mahasiswa/Alumni Universitas Negeri Medan
Jawaban terverifikasi
32
3.2 (4 rating)
CP
Christopher Pramisworo
Jawaban tidak sesuai
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia