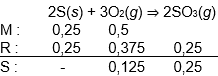Iklan
Iklan
Pertanyaan
Sebanyak 8 g belerang dibakar dengan 16 g gas oksigen. Jika pada pembakaran tersebut dihasilkan gas belerang trioksida, pernyataan berikut yang tidak benar adalah ...
Sebanyak 8 g belerang dibakar dengan 16 g gas oksigen. Jika pada pembakaran tersebut dihasilkan gas belerang trioksida, pernyataan berikut yang tidak benar adalah ...
Belerang bertindak sebagai pereaksi pembatas.
Terdapat sisa gas oksigen sebanyak 4 g.
Terbentuk gas belerang trioksida sebanyak 20 g.
Perbandingan massa oksigen tersisa dan belerang trioksida adalah 4 : 5.
Untuk menghasilkan gas belerang trioksida maksimum, belerang harus habis bereaksi.
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
11
5.0 (1 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia