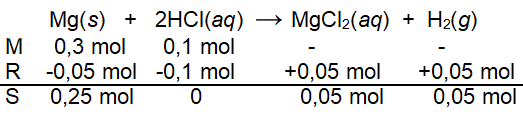Iklan
Iklan
Pertanyaan
Sebanyak 7,2 g logam Mg direaksikan dengan 100 mL larutan HCl 1 M sesuai persamaan reaksi berikut. Mg ( s ) + 2 HCI ( a q ) → MgCl 2 ( a q ) + H 2 ( g ) Jika diketahui A r :Mg = 24 g mol − 1 , H = 1 , dan Cl = 35,5 , tentukan: massa zat sisa
Sebanyak 7,2 g logam Mg direaksikan dengan 100 mL larutan HCl 1 M sesuai persamaan reaksi berikut.
Jika diketahui : Mg = 24 , H = 1 , dan Cl = 35,5
, tentukan:
massa zat sisa
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
13
5.0 (3 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia