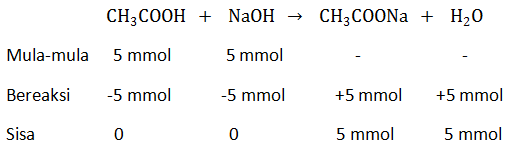Iklan
Iklan
Pertanyaan
Sebanyak 50 mL CH 3 COOH dititrasi dengan NaOH 0,1 M, titik akhir titrasi terjadi pada volume NaOH 50 mL dan K a CH 3 COOH = 1 0 − 5 . Pernyataan berikut yang tepat adalah .... pH larutan penitrasi adalah 13. Konsentrasi adalah 0, 1 M. pH larutan asam sebelum dititrasi adalah 3. Indikator yang paling tepat adalah fenolftalein.
Sebanyak 50 mL dititrasi dengan NaOH 0,1 M, titik akhir titrasi terjadi pada volume NaOH 50 mL dan . Pernyataan berikut yang tepat adalah ....
- pH larutan penitrasi adalah 13.
- Konsentrasi
adalah 0, 1 M.
- pH larutan asam sebelum dititrasi adalah 3.
- Indikator yang paling tepat adalah fenolftalein.
1, 2, dan 3 SAJA yang benar.
1 dan 3 SAJA yang benar.
2 dan 4 SAJA yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
RH
R. Harmiasri
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
20
4.6 (3 rating)
KD
Kal's Dragster
Makasih ❤️
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia