Iklan
Iklan
Pertanyaan
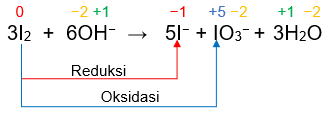
3 I 2 + 6 OH − → 5 I − + IO 3 − + 3 H 2 O Pernyataan yang benar dari reaksi di atas adalah ... Molekul I 2 mengalami oksidasi dan sekaligus mengalami reduksi. Bilangan oksidasi atom I berubah dari 0 menjadi − 1 dan + 5 . Bilangan oksidasi atom oksigen tidak mengalami perubahan. Reaksi di atas termasuk autoredoks.
Pernyataan yang benar dari reaksi di atas adalah ...
- Molekul mengalami oksidasi dan sekaligus mengalami reduksi.
- Bilangan oksidasi atom I berubah dari 0 menjadi dan .
- Bilangan oksidasi atom oksigen tidak mengalami perubahan.
- Reaksi di atas termasuk autoredoks.
Jika jawaban (1), (2), dan (3) benar.
Jika jawaban (1) dan (3) yang benar.
Jika jawaban (2) dan (4) yang benar.
Jika hanya jawaban (4) yang benar.
Jika semua jawaban (1), (2), (3), dan (4) benar.
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
5
5.0 (3 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia