Iklan
Iklan
Pertanyaan
Percobaan titrasi antara 10 mL larutan H 2 SO 4 dengan NaOH ditunjukkan pada gambar berikut. Titik akhir titrasi tercapai setelah penambahan 10 mL NaOH. Massa NaOH yang bereaksi pada titrasi tersebut sebanyak.... ( Mr NaOH = 40 g mol − 1 )
Percobaan titrasi antara 10 mL larutan dengan NaOH ditunjukkan pada gambar berikut.
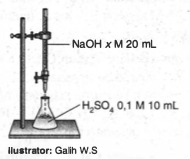
Titik akhir titrasi tercapai setelah penambahan 10 mL NaOH. Massa NaOH yang bereaksi pada titrasi tersebut sebanyak....
0,04 g
0,08 g
0,40 g
0,80 g
8,00 g
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
16
5.0 (1 rating)
AM
Adrik Maromi
Bantu
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia
















