Energi ikatan rata-rata adalah energi rata-rata yang diperlukan untuk memutuskan sebuah ikatan dari seluruh ikatan suatu molekul gas menjadi atom-atom gas. Pada soal di atas, akan dicaari energi ikatan rata-rata  dalam
dalam  , maka energi ikatan rata-rata
, maka energi ikatan rata-rata  merupakan energi rata-rata yang diperlukan untuk memutuskan sebuah ikatan
merupakan energi rata-rata yang diperlukan untuk memutuskan sebuah ikatan  dari seluruh ikatan molekul gas
dari seluruh ikatan molekul gas  menjadi atom-atom gasnya.
menjadi atom-atom gasnya.
Pertama-tama dihitung terlebih dahulu besar perubahan entalpi gas  menjadi atom gas C dan atom gas O dengan menggunakan hukum Hess. Untuk menentukan
menjadi atom gas C dan atom gas O dengan menggunakan hukum Hess. Untuk menentukan  reaksi penguraian gas
reaksi penguraian gas  menjadi atom gas C dan atom gas O dapat dilakukan dengan cara menjumlahkan ketiga reaksi pada soal dengan catatan:
menjadi atom gas C dan atom gas O dapat dilakukan dengan cara menjumlahkan ketiga reaksi pada soal dengan catatan:
a) Pada reaksi 1, letak gas  yang akan mengalami reaksi penguraian berada pada ruas kanan, dimana semestinya letak gas
yang akan mengalami reaksi penguraian berada pada ruas kanan, dimana semestinya letak gas  berada pada ruas kiri, maka reaksi 1 harus dibalik arahnya dan nilai
berada pada ruas kiri, maka reaksi 1 harus dibalik arahnya dan nilai  tandanya berubah menjadi positif.
tandanya berubah menjadi positif.
b) Pada reaksi 2 dan 3, letak atom C dalam fasa gas dan atom O fasa gas telah berada pada ruas yang benar, yaitu pada ruas kanan, sehingga arah reaksi tidak perlu diubah dan tanda pada nilai  juga tetap.
juga tetap.
Selanjutnya persamaan reaksi-reaksi tersebut disusun dan dilakukan eliminasi pada senyawa yang sama dan berfasa sama pada arah ruas yang berlawanan. Persamaan reaksinya dapat disusun sebagai berikut:
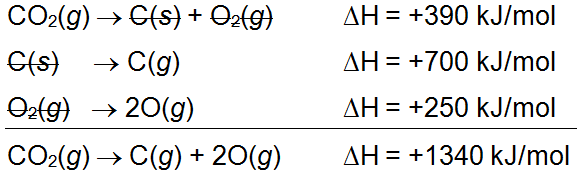
Berdasarkan hasil persamaan reaksi di atas, didapatkan nilai perubahan entalpi atau  penguraian gas
penguraian gas  menjadi atom gas C dan atom gas O adalah +1340 kJ/mol. Selanjutnya energi ikatan rata-rata dapat ditentukan dengan cara sebagai berikut.
menjadi atom gas C dan atom gas O adalah +1340 kJ/mol. Selanjutnya energi ikatan rata-rata dapat ditentukan dengan cara sebagai berikut.

Jadi, jawaban yang tepat adalah D.