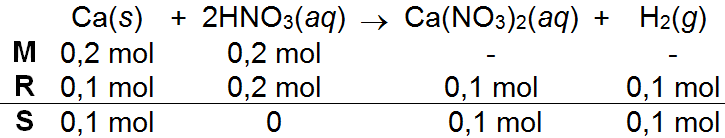Iklan
Iklan
Pertanyaan
Diberikan persamaan reaksi berikut: Ca ( s ) + HNO 3 ( a q ) → Ca ( NO 3 ) 2 ( a q ) + H 2 ( g ) Benu mereaksikan 8 gram kalsium dengan 12,6 gram larutan HNO 3 . Jika A r H = 1, N = 14, O = 16, Ca = 40, maka tentukan: a. Zat / reaktan yang berperan sebagai pereaksi pembatas, b. Massa reaktan yang tersisa, c. Massa Ca ( NO 3 ) 2 yang terbentuk.
Diberikan persamaan reaksi berikut:
Benu mereaksikan 8 gram kalsium dengan 12,6 gram larutan . Jika H = 1, N = 14, O = 16, Ca = 40, maka tentukan:
a. Zat / reaktan yang berperan sebagai pereaksi pembatas,
b. Massa reaktan yang tersisa,
c. Massa yang terbentuk.
Iklan
AK
A. Kusbardini
Master Teacher
Mahasiswa/Alumni UIN Syarif Hidayatullah Jakarta
Jawaban terverifikasi
6
3.0 (2 rating)
SM
Syarifatul Muharami
Mudah dimengerti
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia