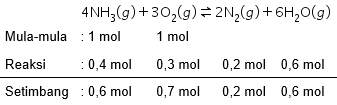Iklan
Iklan
Pertanyaan
Dalam ruang yang volumenya 1 L, terdapat reaksi kesetimbangan: 4 NH 3 ( g ) + 3 O 2 ( g ) ⇌ 2 N 2 ( g ) + 6 H 2 O ( g ) Bila pada keadaan awal terdapat 1 mol NH 3 dan 1 mol O 2 dan pada keadaan akhir jumlah mol berkurang menjadi 0,7 mol; maka nilai K c dari reaksi tersebut adalah....
Dalam ruang yang volumenya 1 L, terdapat reaksi kesetimbangan:
Bila pada keadaan awal terdapat 1 mol dan 1 mol dan pada keadaan akhir jumlah mol berkurang menjadi 0,7 mol; maka nilai dari reaksi tersebut adalah ....
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
21
5.0 (2 rating)
p
praatiwi
Ini yang aku cari! Pembahasan lengkap banget Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia