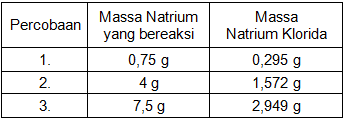
Hukum perbandingan tetap (hukum Proust) menyatakan bahwa perbandingan massa unsur-unsur penyusun senyawa adalah tetap. Untuk mengetahui perbandingan massa unsur-unsur dalam suatu senyawa dengan menjumlahkan massa unsur-unsur yang direaksikan harus sama dengan massa hasil reaksi.
Pada soal ini, untuk mencari apakah ketiga percobaan memiliki perbandingan yang sama (tetap), maka gunakan cara perbandingan massa unsur dengan massa atom relatif unsur tersebut:
Massa unsur ClMassa unsur Na = Ar ClAr NaMassa unsur ClMassa unsur Na = 35,523Massa unsur ClMassa unsur Na =35,5 : 2323 : 23Massa unsur ClMassa unsur Na = 1,5 : 0,51 : 0,5Massa unsur ClMassa unsur Na = 32
Jadi, perbandingan massa unsur-unsur yang bereaksi adalah:
Na + Cl → NaCl 2 3 (2+3)
Percobaan 1:
Massa NaCl = massa Na + massa Cl 5 2 3 0,295 0,75 gr ?massa NaCl :5x = 0,295 x = 50.295 x = 0,059 gramMassa Cl = 3xMassa Cl = 3 (0,059)Massa Cl = 0,177 gMassa Na = 2xMassa Na = 2(0,059)Massa Na = 0,118 gMassa Na yang tidak bereaksi :=0,75 − 0,118= 0,632 g
Percobaan 2:
Massa NaCl = massa Na + massa Cl 5 2 3 1,572 g 4 gr ?massa NaCl :5x = 1,572 x = 50,1572 x = 0,314 gramMassa Cl = 3xMassa Cl = 3 (0,314)Massa Cl = 0,942 gMassa Na = 2xMassa Na = 2(0,314)Massa Na = 0,628 gMassa Na yang tidak bereaksi :=4 − 0,628= 3,372 g
Percobaan 3:
Massa NaCl = massa Na + massa Cl 5 2 3 2,949 g 7,5 gr ?massa NaCl :5x = 2,949 x = 52,949 x = 0,589 gramMassa Cl = 3xMassa Cl = 3 (0,589)Massa Cl = 1,767 gMassa Na = 2xMassa Na = 2(0,589)Massa Na = 1,178 gMassa Na yang tidak bereaksi :=7,5 − 2,949= 6,322 g
Perbandingan massa Na dan Cl pada percobaan 1, 2, dan 3:
Percobaan 1Na : Cl = 0,118 : 0,177 =0,1770,1880,177:0,177 = 0,6 : 1 = 2 : 3Percobaan 2Na : Cl = 0,628 : 0,942 =0,6280,6280,628:0,942 = 1 : 1,5 = 2 : 3Percobaan 3Na : Cl = 1,178 : 1,767 =1,1781,1781,178:1,767 = 1 : 1,5 = 2 : 3
Jadi, berdasarkan perhitungan terbukti bahwa percobaan tersebut memenuhi hukum perbandingan tetap dengan perbandingan Na : Cl = 2 : 3.