YY
Yolamnda Y
27 Juli 2022 08:24
Iklan
Iklan
YY
Yolamnda Y
27 Juli 2022 08:24
30
1
Iklan
Iklan
IY
I. Yassa
18 Agustus 2022 03:03
Jawaban terverifikasi
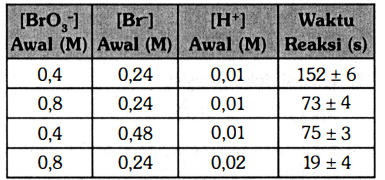
Jawaban: C Laju reaksi dapat diartikan sebagai laju berkurangnya konsentrasi reaktan per satuan waktu dan laju bertambahnya konsentrasi produk per satuan waktu. Untuk mengetahui rumus laju pada soal, perlu mengetahui variabel kontrol dan bebas untuk mendapatkan nilai orde reaksi pada pereaksi yaitu BrO3⁻, Br⁻, dan H⁺. Orde reaksi menunjukkan hubungan antara konsentrasi dengan laju reaksi. Orde reaksi BrO3⁻ Dalam menentukan orde reaksi BrO3⁻, maka kita perlu menentukan Br⁻ dan H⁺ sebagai variabel kontrol (memiliki konsentrasi tetap). Hal tersebut ada pada percobaan ke 1 dan 2. ([BrO3⁻]1/[BrO3⁻]2)^x = (v1/v2) (0,4 M/0,8 M)^x= ((1/t1)/(1/t2)) (1/2)^x= ((1/152)/(1/76)) (1/2)^x= (76/152) (1/2)^x= (1/2)¹ x= 1 Orde reaksi Br⁻ Dalam menentukan orde reaksi Br⁻, maka kita perlu menentukan BrO3⁻ dan H⁺ sebagai variabel kontrol (memiliki konsentrasi tetap). Hal tersebut ada pada percobaan ke 1 dan 3. ([Br⁻]1/[Br⁻]3)^y = (v1/v3) (0,24 M/0,48 M)^y= ((1/t1)/(1/t3)) (1/2)^y= ((1/152)/(1/76)) (1/2)^y= (76/152) (1/2)^y= (1/2)¹ y= 1 Orde reaksi H⁺ Dalam menentukan orde reaksi H⁺, maka kita perlu menentukan BrO3⁻ dan Br⁻ sebagai variabel kontrol (memiliki konsentrasi tetap). Hal tersebut ada pada percobaan ke 2 dan 4. ([H⁺]2/[H⁺]4)^z = (v2/v4) (0,24 M/0,48 M)^z= ((1/t2)/(1/t4)) (1/2)^z= ((1/76)/(1/19)) (1/2)^z= (76/19) (1/2)^z= (1/4) (1/2)^z= (1/2)² z= 2 Rumus laju reaksi secara umum dituliskan sebagai: v= k [pereaksi]^orde Dengan demikian, rumus laju reaksi pada soal adalah: v = k[BrO3⁻]¹ [Br⁻]¹ [H⁺]² v = k[BrO3⁻] [Br⁻] [H⁺]² Jadi, rumus laju reaksinya adalah v = k[BrO3⁻][Br⁻][H⁺]²
· 0.0 (0)
Iklan
Iklan

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!